今日は、日本薬局方についての話を書こうと思います。
薬学部の人だったら授業で日本薬局方のことを習ったと思いますが、医薬品の品質基準や試験法などの各種情報がまとめられているものになります。
日本薬局方は、解説がついていない通常のものでしたら厚労省のHPで確認することができます。
ちなみに、日本薬局方ですが微生物だけ規格の読み方が少し違ったりします。
微生物の規格はどう違うか?
ちなみに医薬品の基本は菌を限りなく、低く抑えることですが、日局の参考情報「非無菌医薬品の微生物学的品質特性」でその基準が示されています。
下記のような感じです。
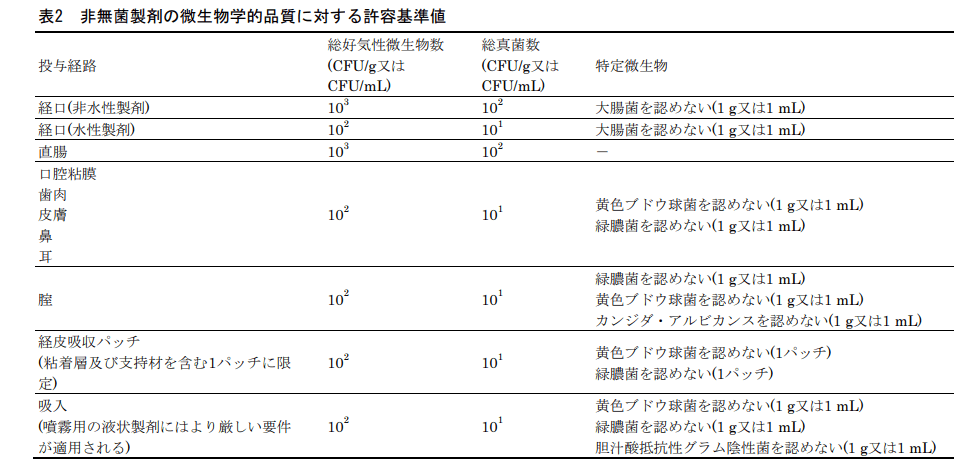
経口(非水性製剤)だと総好気性微生物数は1,000CFU/gですね。
ちなみにCFUですが、Colony forming unitで培地上に生じるコロニーの数です。
他の試験項目だと1,000コロニー以下かとなるかと思いますが、微生物試験はその通りではありません。
なんと、微生物試験の場合10³という表記の場合、最大許容値は2,000になります。
一般試験法「微生物限度試験法」と参考情報「非無菌医薬品の微生物学的品質特性」の両方に下記のような記載があります。
「微生物学的品質の許容基準が規定されているときは,以下のように判定する.
10CFU:最大許容数=20,
10²CFU:最大許容数=200,
10³CFU:最大許容数=2000,以下同様.」
これですが、微生物試験は、誤差が大きい試験と言われているのでこのような記載があると言われています。
この記載は原料メーカー泣かせ...。
この記載ですが、地味に原料メーカー泣かせです。
日局の参考情報「非無菌医薬品の微生物学的品質特性」には非無菌医薬品の原料に対する基準も示されています。
総好気性微生物数で1,000CFU/g、総真菌数で100CFU/gです。
最終製剤では基本的に微生物試験は社内での出荷時の規格で、お客さんにデータがでることはありません。
最終製剤では分析表ではなく、添付文書しか入っていないのを思い出して頂けたらと思います。
しかし、原料メーカーは、製剤メーカーに分析表添付して原料を納品します。
1,000CFU/gで実測値1,800なら日局の記載だったら合格のはずです。
ただ、製剤メーカーですんなり受け入れられるというかとそうではなく、何となくわかると思いますが数字上で判断する人がいるので絶対もめます。
また、試験の性質上2倍程度の誤差はあるということでのこの表記なので、600で出荷したときにメーカーの定期的にやっている受入れ試験で1,100がでたときにも確実にもめます。
そのため、安心をとろうと思うと少し厳しめに出荷規格を設定しなければいけません。
ちゃんとこの辺のことを理解している人だけならいいのですが、見た目の数字上でオラオラいってくる人もいるんですよね...。
まとめ
今回は、ちょっとした規格の話ですが、参考になったら嬉しいと思います。



コメント